|
Ce dossier sur les nanofluides intervient après avoir été contacté par Jean-Antoine Gruss, ingénieur travaillant pour le Commissariat à l’Énergie Atomique (CEA) au laboratoire des échangeurs thermiques (DTS/LETH). La discussion engagée avait pour but d’avoir des renseignements et des conseils sur des démonstrateurs pour réaliser quelques expériences dans un domaine qui nous intéresse : le refroidissement liquide de PC. C’est donc l’occasion pour nous d’évoquer ce domaine encore relativement au stade de la recherche, de parler des particularités de ces nanofluides que nous utiliserons pour améliorer l’efficacité de nos échangeurs de chaleur et aussi de discuter des quelques tests réalisés avec un watercooling classique. Merci à Jean-Antoine d’avoir partagé une partie de ses résultats pratiques (page 7). Comment améliorer encore plus l’efficacité d’un refroidissement liquide ? Quand on voit les fabricants se « battre » sur les waterblocks, par exemple, alors qu’ils ne sont pas loin du mur, on peut se demander ce que l’on pourrait bien modifier pour gagner en performance sans pour autant avoir une machine à la ventilation très bruyante ou qui consomme énormément. Si on peut optimiser un écoulement ou augmenter la surface d’échange entre le fluide caloporteur et les parois d’un échangeur, ces deux aspects trouvent assez rapidement des limites pratiques et économiques. À y regarder de plus près, on dispose a priori d’assez peu de marge de manoeuvre sans vouloir jouer la démesure. À propos de l’efficacité, supposons que l’on ait deux circuits de watercooling A et B, que A permette de maintenir le processeur à 25 °C au dessus de la température de l’air ambiant et que B n’arrive qu’à atteindre un écart de 30 °C dans les mêmes conditions. Le circuit A est alors plus efficace que B, mais les deux dissipent la même puissance, 100 W si le processeur en fournit 100. Ça dissipe mieux, et non pas plus, pour un circuit de watercooling donné. Avec un processeur doté d’un IHS non enlevé, les divers éléments qui interviennent dans le transfert de chaleur, ainsi que les principaux facteurs d’amélioration des performances thermiques, sont récapitulés ci-dessous (Figure 1). 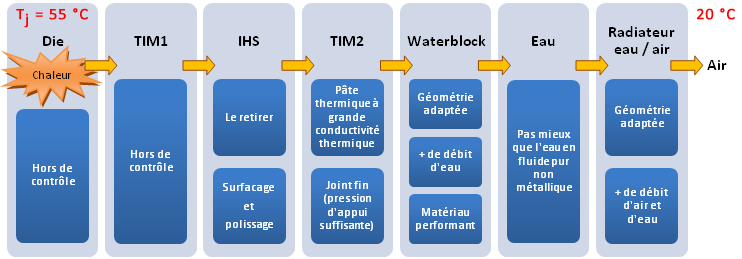 Fig. 1 : Trajet de la chaleur au travers des divers éléments présents entre le die et l’air Fig. 1 : Trajet de la chaleur au travers des divers éléments présents entre le die et l’airChaque élément est source d’une partie de l’inefficacité générale (comprendre « la différence de température entre l’air et le die »). Chacun engendre un écart de température, car chacun impose une certaine résistance thermique au passage de la chaleur. La traversée d’une épaisseur de matière ou d’une interface de contact par un flux de chaleur ne se fait pas sans conséquence. Généralement, plus il y a d’éléments ou d’interfaces à traverser et plus l’efficacité générale en pâtit. Et si on s’attaquait au fluide pour une fois ?Dans cette recherche perpétuelle d’amélioration, le fluide n’est jamais remis en question pour des raisons simples : la plupart pense qu’il ne peut pas faire l’objet d’une évolution et dans le cas contraire, il ne nous est justement pas possible de l’améliorer facilement. En effet, en termes de fluides purs non métalliques, l’eau est de loin ce qu’il y a de mieux pour obtenir globalement les meilleures performances dans les conditions normales de température et de pression. Les fluides à base d’huiles, d’alcools ou d’origine synthétique (Fluorinert chez 3M par exemple) sont en deçà, voire très en deçà, des capacités de l’eau pure. Cette eau étant abondante et bon marché, ça en fait le fluide caloporteur par excellence. Le gros point faible de tous ces fluides est de disposer d’une conductivité thermique ridicule par rapport à la plupart des solides cristallins et des métaux en particulier. La différence atteint un à trois ordres de grandeur. Par exemple, l’eau a une conductivité thermique 668 fois moins importante que celle du cuivre à température ambiante. En revanche, les fluides disposent d’une capacité thermique massique bien supérieure aux métaux, qui leur permet d’emmagasiner beaucoup d’énergie par unité de masse sans trop grimper en température. Par exemple, pour 4182 joules absorbés, un kilogramme d’eau grimpera de 1 °C alors qu’un kilogramme de cuivre grimpera de 10,8 °C.
Pour avoir la meilleure efficacité, la conductivité thermique et la capacité thermique massique doivent être les plus élevées possible. Une faible conductivité signifie que la chaleur mettra beaucoup de temps à se répartir seule dans le liquide par conduction pure (sans déplacement global de matière). Comme un transfert thermique entre un fluide et une paroi utilise à la fois les modes conductif et convectif, elle est un facteur limitant pour bon nombre d’applications impliquant de larges quantités d’énergie à évacuer ou bien dissipées sur de petites surfaces. C’est un inconvénient sérieux, car on ne peut pas sans cesse augmenter la taille des équipements de refroidissement pour compenser. Par implication, la valeur de cette conductivité thermique bride aussi des paramètres comme le coefficient d’échange convectif qu’on souhaite le plus élevé possible. Un écoulement d’eau rapide et bien turbulent ne suffit-il pas ?On le verra un peu plus en détail ensuite, mais le fluide au voisinage immédiat d’une paroi a une vitesse très faible par rapport au reste de l’écoulement à cause des effets de la viscosité, aussi bien dans un écoulement laminaire que turbulent d’ailleurs. En exagérant légèrement, cette très fine couche de fluide lent, la fameuse « couche limite », agit donc un peu comme un isolant thermique entre le fluide froid et la paroi chaude. En effet, le transfert d’énergie de la paroi vers le fluide, à travers cette pellicule liquide, se fait localement par conduction (comme un solide) et non pas par convection, ce qui n’est en rien arrangé par le fait que l’eau dispose d’une bien mauvaise conductivité thermique. Voilà l’une des raisons qui poussent à faire circuler le fluide de refroidissement le plus rapidement possible près des parois du waterblock. Cela augmente le niveau de turbulence localement et minimise la stagnation du fluide près de ces parois, même si elle est toujours présente (viscosité jamais nulle). On emploie alors des jets d’eau rapides, des grilles de picots ou des aspérités diverses et variées pour augmenter la surface d’échange, pour contraindre le fluide a être brassé et empêcher que la couche limite ne se développe à sa guise. On souhaite ainsi éviter que ce soit toujours les mêmes molécules d’eau proches de la paroi qui se chargent d’absorber sa chaleur, avec une hausse de leur température à la clé et une difficulté à la transmettre rapidement à d’autres molécules du fait de la faible conductivité thermique du fluide. C’est pour cela qu’un très faible débit dans un waterblock est à éviter contrairement à une croyance populaire qui veut généralement le contraire (soi-disant pour laisser le temps à l’eau de se charger en chaleur…). L’écoulement interne tend à devenir laminaire, calme, sans brassage, ce qui conduit à des températures de jonction plus élevées pour les puces électroniques, car les échanges de chaleur paroi-fluide et au sein même du fluide se font de plus en plus par conduction pure vu qu’il n’y a plus de turbulence. Le fluide glisse sur lui-même en couches infiniment minces, indépendantes et superposées sans se mélanger en quelque sorte. Au contraire, un écoulement turbulent ou brassé améliore l’évacuation de la chaleur loin de la paroi et la répartition au sein du volume grâce aux remous tourbillonnaires et chaotiques qui se forment au sein du fluide (Figure 2). Le mécanisme de conduction entre les molécules de fluide est grandement amélioré dans tout le volume puisque l’énergie thermique est distribuée beaucoup plus rapidement avec d’innombrables collisions moléculaires : c’est la convection (action combinée de la conduction, de l’accumulation d’énergie et du mouvement du fluide). Avoir plus de turbulence signifie un échange de meilleure qualité et donc potentiellement plus d’échange possible. Exemple
Prenons un tube rond de Ø10 mm dont la paroi interne est constamment maintenue à 40 °C. On y fait circuler de l’eau (entrante à 25 °C) à deux régimes différents, l’un purement laminaire (0,1 m/s) et l’autre turbulent (1 m/s). On simule les écoulements qui se produisent dans ces tubes et on trace les deux évolutions de la température moyenne du fluide à 150 mm de l’entrée du tube. Le fluide va donc se situer entre 25 et 40 °C suivant où l’on se positionne sur le rayon, de 0 à 5 mm, plus froid proche du centre et plus chaud proche de la paroi. 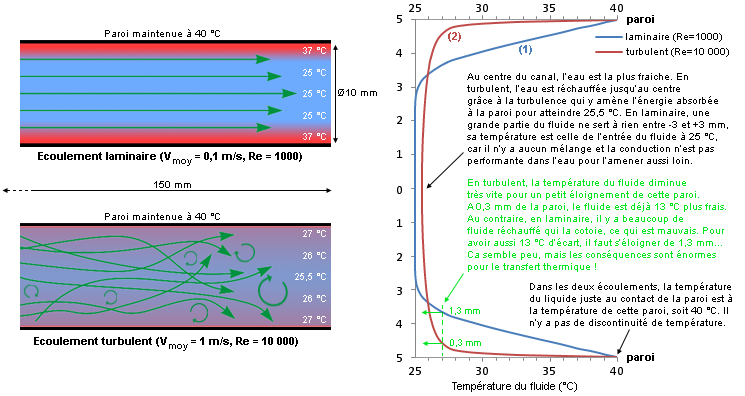 Fig.2 : Le brassage augmente l’homogénéité de température au sein du fluide et permet un échange thermique de meilleure qualité Fig.2 : Le brassage augmente l’homogénéité de température au sein du fluide et permet un échange thermique de meilleure qualitéDans le cas laminaire avec la courbe (1), l’évolution de la température du fluide près de la paroi est linéaire dans une grande partie de la variation sur environ deux millimètres ici, car le transfert se fait uniquement par conduction pure comme dans les solides (loi de Fourier). On peut comprendre que ce transfert ne soit pas exceptionnel vu la valeur médiocre de la conductivité thermique de l’eau. Au contraire, en turbulent avec la courbe (2), il n’y a qu’une très faible couche de fluide réchauffé au voisinage immédiat de la paroi d’à peine quelques dixièmes de millimètres grâce à la vitesse et au brassage intense. L’écoulement turbulent permet d’homogénéiser un maximum la température du fluide dans tout le volume et de rejeter la chaleur loin de cette paroi. Le cas turbulent est bien évidemment meilleur grâce à la plus grande proximité de fluide frais près de la paroi, ce qui favorise l’échange thermique (proportionnel à l’écart de température paroi-fluide). En laminaire, la simulation nous donne un flux thermique transféré dans l’eau de 54 W, alors qu’il grimpe à 383 W en turbulent. Attention, l’exemple est à température de paroi imposée, d’où la puissance plus importante transférée dans un meilleur écoulement. Un waterblock est lui soumis à un flux thermique imposé (le processeur y injecte 100 W par exemple), c’est donc l’inverse dans ce cas. Si l’écoulement permet un échange plus efficace, les parois du waterblock deviennent moins chaudes. Par effet de cascade, tout ce qui se trouve sous elles va voir sa température diminuer jusqu’au die du processeur refroidi. Les deux courbes d’évolution de température permettent aussi de comprendre pourquoi il est plus intéressant de vouloir passer d’un très faible débit (50 L/h) à un débit moyen (200 L/h), plutôt que d’un débit moyen à un fort débit (500 L/h) dans n’importe quel circuit de watercooling (Figure 3). Dans le premier cas, la couche de fluide réchauffée près des parois peut diminuer massivement en passant progressivement de l’allure (1) à l’allure (2). Dès lors, on imagine aisément que lorsqu’on a déjà l’allure (2) avec notre débit moyen, l’épaisseur de cette couche de fluide réchauffé ne peut pratiquement plus diminuer si l’on augmente encore le débit, puisqu’elle est déjà très fine. On y gagnera quand même un peu, car elle diminuera tout de même légèrement avec la turbulence accrue, mais le gain est bien moindre. Plus on débitera, moins on gagnera, car on tend vers un palier infranchissable, peu importe l’échangeur et le fluide. 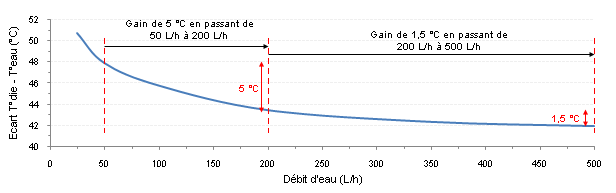 Fig.3 : Écart de température réel à pleine charge entre le CPU et l’eau avec un Apogee GT sur un Core 2 Duo E6300 B1 @ 3010 MHz et 1,59 V Fig.3 : Écart de température réel à pleine charge entre le CPU et l’eau avec un Apogee GT sur un Core 2 Duo E6300 B1 @ 3010 MHz et 1,59 VPar ailleurs, avec un débit élevé, on évite également à l’eau de trop se réchauffer entre l’entrée et la sortie de l’échangeur, sans quoi les températures grimpent encore un peu puisque le fluide interne aura une température moyenne plus élevée. Heureusement, la très grande capacité thermique de l’eau permet de minimiser cet aspect tant qu’on a un débit raisonnable. Dans une majorité de cas, ce point n’est donc pas un souci en soi puisque l’écart sortie-entrée d’un waterblock quelconque est inférieur à 1 °C (Figure 4). 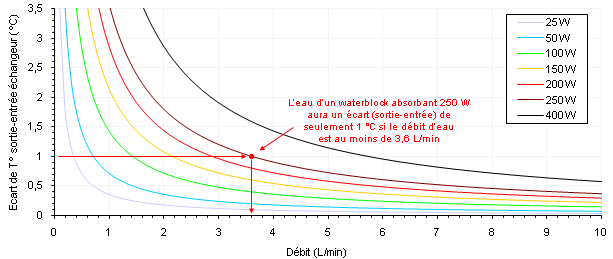 Fig.4 : Écart de température entre l’entrée et la sortie d’un échangeur de chaleur quelconque soumis à un débit d’eau variable Fig.4 : Écart de température entre l’entrée et la sortie d’un échangeur de chaleur quelconque soumis à un débit d’eau variableAvoir de la turbulence dans le fluide, c’est donc une très bonne chose pour l’efficacité d’un refroidissement quelconque. Cependant, assez rapidement, on a beau augmenter le débit pour améliorer toujours plus l’échange convectif, le gain devient très faible par rapport aux moyens déployés pour les raisons évoquées ci-dessus et on se retrouve finalement avec de nouveaux inconvénients (bruit, consommation électrique, encombrement, etc.). Les propriétés thermophysiques du fluide ne permettent alors pas de faire tellement mieux. Il faut donc trouver un moyen d’augmenter sa conductivité thermique pour espérer augmenter sa diffusivité thermique, tout en évitant les inconvénients au maximum. Alors, quelles alternatives ?On pourrait penser à utiliser certains alliages métalliques liquides à température ambiante qui disposent d’une bien meilleure conductivité thermique que l’eau, mais leur utilisation requiert une pompe particulière vu leur densité plus élevée (l’alliage de gallium + indium + étain est 6,4 fois plus dense que l’eau par exemple). Ils peuvent aussi poser des problèmes de toxicité, de réactions chimiques avec divers métaux, sans parler de leur aspect moins pratique, de leur disponibilité ou de leur coût. Ce n’est d’ailleurs pas certain qu’ils soient tellement meilleurs, car on ne peut préjuger de rien en se basant uniquement sur la valeur de la conductivité thermique. En effet, les autres propriétés interviennent également, sachant que certaines sont beaucoup moins bonnes que celles de l’eau. Le débit atteint dans la boucle de refroidissement aura aussi toute son importance. Pour la suite, on s’occupera uniquement d’écoulements turbulents en convection forcée (utilisation d’une pompe pour déplacer le fluide). De plus, on restera concentré sur les fluides faciles d’accès que l’on utilise couramment et qui font l’objet de plus en plus d’études pour les améliorer, notamment l’eau. Un moyen pour parvenir à intensifier les échanges thermiques : doper le fluide pour en faire un nanofluide. Nanofluide, késako ? La conductivité thermique d’un liquide non métallique étant très faible, il faut trouver un moyen de l’augmenter artificiellement. Or, quoi de plus simple que d’ajouter des morceaux d’un matériau, doté d’une bonne conductivité thermique, dans le liquide de base pour espérer augmenter la valeur moyenne de la conductivité thermique du mélange ? Voilà le but recherché d’un nanofluide. Un nanofluide est une solution colloïdale contenant des particules solides de petite taille, désignées sous le terme de « nanoparticules », en suspension dans un liquide de base dont on veut modifier ou améliorer certaines des propriétés, notamment thermiques. En termes simples, c’est de la poudre ultrafine et non soluble mélangée à un liquide. C’est donc différent d’un ajout de sel de cuisine dans de l’eau par exemple, où la molécule de chlorure de sodium (NaCl) se casse et passe sous une forme ionique (Na+ et Cl-). On peut faire un rapprochement entre un nanofluide et une pâte thermique fluide, car cette dernière contient généralement des particules de matière solide en suspension dans du silicone ou une huile pour un but similaire : améliorer la très faible conductivité thermique de la matrice de base. Les études de ces fluides composites montrent des aptitudes particulièrement intéressantes du fait d’une meilleure conductivité thermique et d’un coefficient d’échange convectif significativement accru par rapport à des liquides classiques, l’eau en particulier. Ils se révéleront être d’excellents candidats pour augmenter les performances des échangeurs de chaleur sans rien avoir à modifier. Ces toutes dernières années, le nombre d’études, de brevets et de publications scientifiques sur les nanofluides a considérablement augmenté du fait de leur potentiel élevé. Nature des nanoparticules
Pour garantir ces exigences, on doit travailler à une échelle submicroscopique pour que les nanoparticules aient une taille et une masse infimes. On les caractérise comme ayant une taille ou un diamètre compris entre 1 et 100 nanomètres (nm), sachant que la molécule d’eau est de l’ordre de 0,25 nm et qu’un nanomètre est égal à un millionième de millimètre (Figure 6). Suivant sa grosseur, une nanoparticule est alors composée de quelques centaines à plusieurs millions d’atomes d’un matériau donné.  Fig. 5 : Il faut éviter que les particules solides ne coulent au bout d’un temps relativement faible Fig. 5 : Il faut éviter que les particules solides ne coulent au bout d’un temps relativement faibleDu fait de cette taille inférieure à 100 nm, on peut aussi définir une nanoparticule comme étant un nanocristal (monocristal de taille nanométrique). Le terme « cristal » fait référence à l’arrangement spatial bien ordonné et périodique des atomes dans un solide cristallin. Au contraire, des volumes de matière plus importants sont généralement des assemblages de cristaux et présentent des joints de grain avec des atomes disposés plus ou moins aléatoirement pour lier tous ces cristaux mal orientés entre eux. Les métaux ou les céramiques sont de ce type, ce sont des solides polycristallins (il y a des exceptions comme les barreaux de silicium ultrapur pour les puces électroniques et qui sont des monocristaux géants). Le fait d’être monocristallin est le gage d’une structure atomique (quasi) parfaite et ça aura une importance pour la conduction de chaleur dans les nanoparticules.  Fig. 6 : Échelle des dimensions, 1 nanomètre = 0,000 001 millimètre Fig. 6 : Échelle des dimensions, 1 nanomètre = 0,000 001 millimètreOn le détaillera par la suite, mais cette minuscule taille permet d’obtenir une surface de contact extrêmement élevée entre l’ensemble des nanoparticules et le liquide environnant, ce qui est intéressant pour la qualité de l’échange thermique au sein du nanofluide. Cette surface sera d’ailleurs de plus en plus importante avec la réduction de leur taille pour une masse donnée de matériau (plus d’atomes en contact direct avec le liquide et non pas sous la surface de la nanoparticule). On peut quasiment utiliser n’importe quoi pour fabriquer ces nanoparticules et les adapter aux contraintes de l’environnement final d’utilisation. Dans les matériaux classiques, on trouve les métaux purs (aluminium, cuivre, titane, or, argent, fer…), les oxydes métalliques (alumine, oxyde cuivrique, oxyde de zinc…), les semiconducteurs, les céramiques diverses (carbures, nitrures, sulfures…), les nanotubes de carbone, les fullerènes, le diamant, les polymères, les terres rares, etc. La géométrie et la taille moyenne de ces petits morceaux de matière pourront également être variées et adaptées suivant la manière de les fabriquer (sphère, cylindre, disque, tube, filament…). Nature du mélange obtenuLes nanoparticules sont principalement mises en suspension dans de l’eau, de l’huile ou de l’éthylène glycol (l’un des composés du LDR couramment employé dans les watercoolings), même si tout liquide peut être utilisé. Les liquides métalliques peuvent aussi être dopés aux nanoparticules pour les améliorer encore plus, des études de fluide à base de gallium mélangé à des nanotubes de carbone existent par exemple. Ici, on s’intéressera en particulier aux nanofluides avec une base aqueuse, car ce sont les plus performants et intéressants pour nous (Figure 7). La concentration des nanoparticules dans le nanofluide est généralement assez faible et exprimée en pourcentage volume/volume. Cette fraction volumique varie environ de 0,1 à 10 % pour des applications pratiques, voire plus dans des cas particuliers et jusqu’à 20 % pour des nanofluides à base de liquide métallique. Si on souhaite obtenir un litre de nanofluide aqueux à 3 % d’alumine en volume par exemple, on met 30 cm3 de nanopoudre d’alumine dans un récipient, ce qui représente deux cuillères à soupe de 15 mL, et on complète avec de l’eau jusqu’à obtenir un volume de 1000 cm3. La nanopoudre n’est pas de la matière compacte et contient beaucoup d’air en son sein. Suivant les dimensions et les formes des nanoparticules, la masse volumique réelle de l’alumine sous forme de nanopoudre est de l’ordre de 0,1 à 0,8 g/cm3, contre 3,6 g/cm3 pour l’alumine en bloc. Dans notre exemple, cela reviendrait à mélanger 15 grammes de nanopoudre d’alumine dans l’eau si elle a une densité moyenne de 0,5. Pourquoi s’arrêter seulement entre 5 et 10 % au maximum ? Parce qu’ajouter trop de matière solide n’est pas forcément intéressant en soi, notamment à cause de la viscosité qui peut augmenter rapidement. Les trop nombreuses nanoparticules introduites risquent de saturer le fluide, de s’agglomérer les unes aux autres et de couler au fond s’il y en a trop. Il existe donc une concentration optimale pour tirer le meilleur du fluide entre 0,1 et 10 % en général pour des applications nous concernant dans un régime d’écoulement turbulent en convection forcée. La plupart du temps, pour des fractions volumiques de moins de 5 % de nanoparticules d’allure plus ou moins sphérique dans de l’eau, la viscosité dynamique du nanofluide est de l’ordre de deux à trois fois celle de l’eau, soit 2 à 3 mPa/s à 20 °C et elle diminue avec l’augmentation de la température. C’est assez raisonnable, sachant que le moindre liquide de refroidissement pour voiture couramment utilisé dans les circuits de watercooling est généralement un peu plus visqueux que ça. 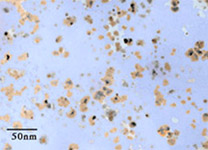    Fig. 7 : Nanofluides vus au microscope électronique : éthylène glycol + cuivre à 0,5 % ; eau + alumine ; eau + or à 2 nm ; eau + nanotubes Fig. 7 : Nanofluides vus au microscope électronique : éthylène glycol + cuivre à 0,5 % ; eau + alumine ; eau + or à 2 nm ; eau + nanotubesEn ce qui concerne l’aspect visuel du nanofluide, il varie principalement selon la technique de fabrication, la nature du matériau, ainsi que la taille des nanoparticules et des agglomérats. Même avec une très faible fraction volumique et le mélange d’une nanopoudre dans de l’eau (méthode « en deux étapes »), celui-ci devient presque à coup sûr opaque à cause des nanoparticules qui empêchent les ondes lumineuses de traverser (interaction matière-rayonnement), puisqu’il est pratiquement impossible d’éviter les regroupements de matière en paquets avec cette méthode, même avec des produits dispersants (Figure 8). Cette opacité se manifeste quand les dimensions des nanoparticules (ou des agrégats) ne sont pas suffisamment réduites par rapport aux longueurs d’ondes présentes dans la lumière visible (400 à 700 nm). L’opacité n’est donc pas simplement liée à la concentration des nanoparticules dans le liquide.  Fig. 8 : Exemples de nanofluides aqueux et opaques avec seulement 1 % de nanoparticules de diverses natures Fig. 8 : Exemples de nanofluides aqueux et opaques avec seulement 1 % de nanoparticules de diverses naturesIl y a aussi des nanofluides qui sont transparents (Figure 9a), même à grande concentration en nanoparticules, lorsque la dispersion est homogène et que les nanoparticules sont très petites. D’une manière générale, ce phénomène de transparence commence à s’observer quand les dimensions des particules en suspension descendent sous les 80 nm environ (Figure 9b). On peut notamment obtenir cette transparence avec des techniques de fabrication « en une étape » qui évitent autant que possible les agglomérations de se produire.  Fig. 9a : Exemples de nanofluides transparents ou colorés Fig. 9a : Exemples de nanofluides transparents ou colorés Fig. 9b : Transparence naissante avec la diminution de la taille moyenne des nanoparticules de SiO2 dans de l’éthanol Fig. 9b : Transparence naissante avec la diminution de la taille moyenne des nanoparticules de SiO2 dans de l’éthanolPar exemple, le nanofluide à base d’eau utilisé ici pour les tests du CEA reste parfaitement transparent, même avec une concentration très importante de 18,5 % en volume (34 % en masse). La couleur et la transparence obtenues peuvent varier en fonction de la taille des nanoparticules, de leur concentration ou de leur forme (effet Tyndall). Cela permet d’apprécier directement et visuellement la qualité ou le type de nanofluide de manière assez précise suivant le matériau utilisé. Évolution du concept : « size does matter » Si l’idée même d’utiliser des particules solides en suspension pour améliorer un liquide est ancienne, puisqu’elle découle notamment des études analytiques de Maxwell vers 1873, ce n’est que depuis les années 1990 que l’utilisation de particules d’échelle nanométrique est étudiée. Cela a été rendu possible grâce au développement de procédés de fabrication particuliers et novateurs. Les études scientifiques antérieures se contentaient de tester des suspensions plus ou moins bien contrôlées de particules de taille millimétrique ou micrométrique, donc 1000 à 1 000 000 de fois plus grosses que des nanoparticules. Celles-ci sont malheureusement par nature bien moins efficaces dans le temps. En effet, elles sédimentent rapidement vu leur masse plus importante et elles réduisent l’efficacité du transfert thermique paroi-fluide en se déposant un peu partout (Figure 10). De plus, il fallait généralement en mettre beaucoup pour avoir des effets observables (concentration >10 %), ce qui accentue les problèmes. 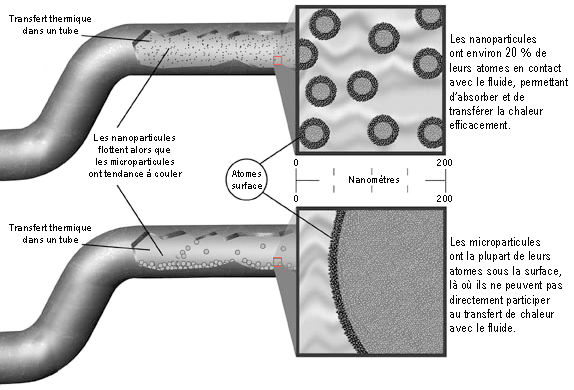 Fig. 10 : Quelques différences majeures entre les microparticules et les nanoparticules Fig. 10 : Quelques différences majeures entre les microparticules et les nanoparticulesCes mini/microparticules ont tendance à induire une érosion soutenue en impactant les diverses parois ou les pièces mobiles si la vitesse d’écoulement est un peu élevée (pour contrer la sédimentation par exemple), car elles ne suivent pas bien les lignes de courant du fait d’une masse plus importante et donc d’une inertie plus importante (Figure 11). Cela peut conduire à une dégradation rapide de la pompe, des tuyaux, des échangeurs, etc. C’est un peu comme faire du décapage mécanique avec des grains de sable projetés à grande vitesse sur une surface, sauf qu’ici ça se fait plus lentement, mais sûrement. Au contraire, les nanoparticules suivent particulièrement bien les différents mouvements du fluide grâce à leurs infimes taille et inertie, ce qui leur confère un énorme avantage et un pouvoir abrasif (quasi) inexistant. 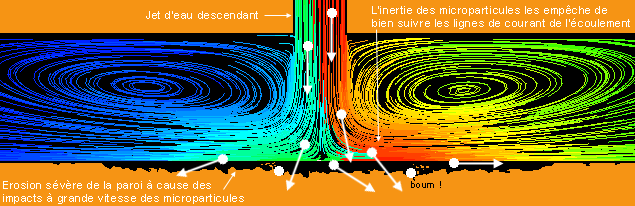 Fig. 11 : Exemple de dégradation possible par abrasion d’une paroi à cause des impacts de mini/microparticules Fig. 11 : Exemple de dégradation possible par abrasion d’une paroi à cause des impacts de mini/microparticulesCette propension à détériorer les surfaces confère aussi aux mini/microparticules une plus grande aptitude à favoriser la corrosion physique. Il peut y avoir destruction de fines couches anodisées (1 à 50 µm) destinées à ralentir fortement les réactions électrochimiques s’il y a présence de divers métaux au contact du liquide dans le circuit. Ces grosses particules entrainent aussi une augmentation sérieuse des pertes de charge, ce qui oblige généralement à augmenter la puissance hydraulique pour compenser, ce qui n’est pas très rentable. Elles ont tendance à boucher de fins canaux du fait de leur taille et de leur dépôt, puis elles offrent beaucoup moins de surface de contact avec le liquide (1000 à 100 000 fois moins que des nanoparticules). Bref, que des inconvénients qui ont conduit à leur éviction… Comment produire ces nanofluides ?Le point délicat est la fabrication de si petits morceaux de matière plus ou moins bien calibrés. Inutile d’essayer d’en faire chez soi en ponçant un bout de cuivre pour en faire de la poussière par exemple. Ça ne fera que des particules de taille micrométrique au mieux, qui encrasseront le circuit. Il y a deux méthodes principales pour obtenir un nanofluide :
Les procédés de fabrication sont de nature physique ou chimique. Ils font l’objet de beaucoup de recherches pour améliorer le coût de production qui reste parfois élevé vu les difficultés de mise en oeuvre et pour obtenir des particules de taille voulue. Chaque méthode a ses inconvénients et certaines ne sont pas aptes à produire de grandes quantités de nanoparticules pour une production de masse vu les contraintes inhérentes au procédé, notamment les méthodes en une étape (Figure 12). Les principaux moyens peuvent être :
| |||||||||||||||||||||||||||||||||||||||
Dossier sur les nanofluides
body{background:#FFF}

 Du fait de sa nature colloïdale, un nanofluide doit être conçu pour être efficace sur du long terme sans avoir d’inconvénients majeurs. Notamment, il ne doit pas permettre de boucher de très fins canaux en générant des dépôts et les particules ne doivent pas couler trop vite par sédimentation à cause de leur densité sous l’effet de la force de pesanteur (Figure 5). Pour accomplir cela, il faut être capable de fabriquer et d’incorporer correctement des grains de matière extrêmement petits. Facile à dire, mais pas très facile à faire…
Du fait de sa nature colloïdale, un nanofluide doit être conçu pour être efficace sur du long terme sans avoir d’inconvénients majeurs. Notamment, il ne doit pas permettre de boucher de très fins canaux en générant des dépôts et les particules ne doivent pas couler trop vite par sédimentation à cause de leur densité sous l’effet de la force de pesanteur (Figure 5). Pour accomplir cela, il faut être capable de fabriquer et d’incorporer correctement des grains de matière extrêmement petits. Facile à dire, mais pas très facile à faire…